'Bijsluiter' van 757 pagina's bewijst niet dat coronavaccin onveilig is
- Dit artikel is meer dan een jaar oud.
- Gepubliceerd op 2 december 2024 om 09:58
- Leestijd: 5 min
- Door: Liesa PAUWELS, AFP Nederland
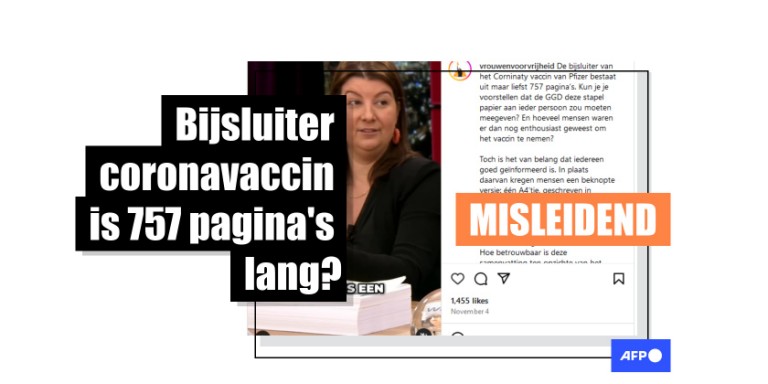
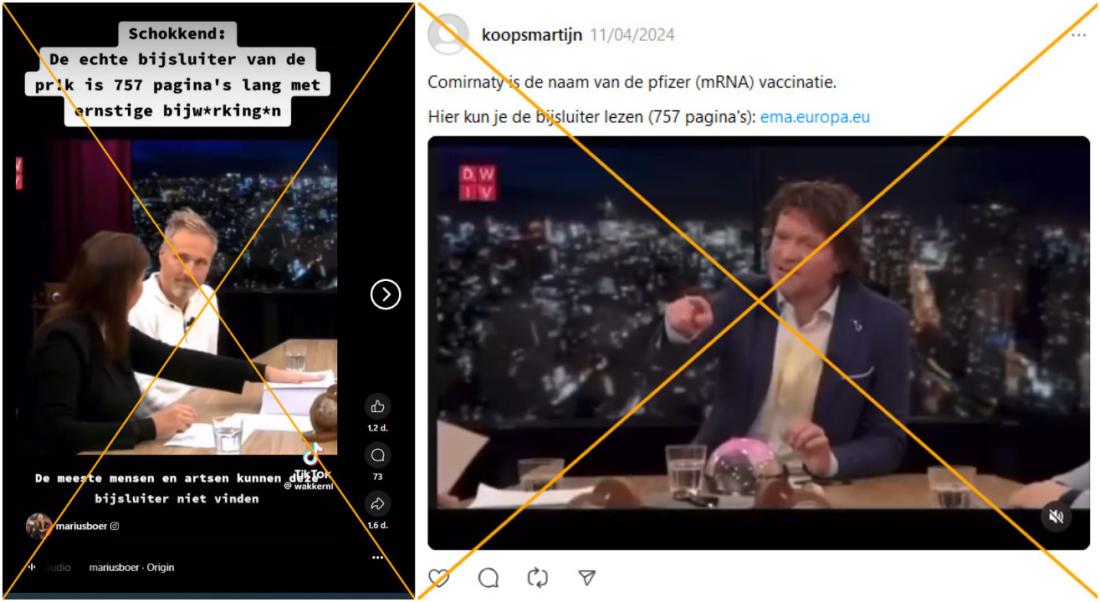
"Schokkend: de echte bijsluiter van de prik is 757 pagina's lang met ernstige bijwerkingen," deelde een socialemediagebruiker op Instagram samen met een reel van een fragment uit de talkshow 'De Wereld is Vierkant' van blkbx.tv, een Nederlandse alternatieve tv-zender. In het fragment bespreken ze de 'bijsluiter' in kwestie en wordt er geïmpliceerd dat de vaccins vanwege de lengte van het document niet veilig kunnen zijn.
Een andere Instagram-reel van hetzelfde fragment werd meer dan 36 000 keer bekeken. Onder de post die op 4 november 2024 werd gepubliceerd, staat te lezen dat "door tegenstrijdigheden te herkennen, in dit geval een bijsluiter van 757 pagina's bij een 'veilig en effectief' vaccin, en aan te kaarten wordt de weg vrijgemaakt voor verandering".
Dezelfde beweringen werden ook gedeeld op verschillende andere socialemediaplatforms zoals Threads, X en Facebook.
Het document dat in de video wordt getoond is echter niet de bijsluiter, maar de productinformatie van alle bestaande versies van het Pfizer-BioNTech coronavaccin. Dit is gedetailleerder dan een bijsluiter en is bedoeld voor zorgverleners. Experts bevestigden aan AFP dat dit in lijn is met wat normaal gesproken geldt voor vaccins.
Productinformatie, geen bijsluiter
In de berichten verwijzen sommige gebruikers rechtstreeks naar het 757 pagina's tellende document waar de gasten in de talkshow het over hadden. Het gaat om een authentiek document dat werd gepubliceerd op de website van het Europees Geneesmiddelenbureau (EMA). EMA is het agentschap van de Europese Unie dat verantwoordelijk is voor de beoordeling van geneesmiddelen die worden goedgekeurd voor de EU-markt.
Hetzelfde document werd ook online gepubliceerd in de geneesmiddelendatabank van het College ter Beoordeling van Geneesmiddelen, de Nederlandse tegenhanger van EMA, die geneesmiddelen op nationaal niveau beoordeelt. In het document wordt de merknaam gebruikt van wat in de volksmond het 'Pfizer'- of 'BioNTech-vaccin' wordt genoemd: Comirnaty.
In tegenstelling tot wat wordt beweerd online, is het document in kwestie echter niet de bijsluiter van het vaccin, maar de productinformatie, ook wel Samenvatting van de Productkenmerken (SmPC) genoemd. De productinformatie bevat meer gedetailleerde informatie dan de bijsluiter, omdat de informatie bedoeld is voor zorgverleners en gebruikt wordt voor de goedkeuringsprocedure van het geneesmiddel. Het bevat niet alleen mogelijke bijwerkingen, maar ook informatie over dosering en toediening en gedetailleerde uitleg over de ingrediënten van het vaccin, en in het geval van Comirnaty, een omschrijving van verschillende versies van het vaccin. Een bijsluiter daarentegen is bedoeld om patiënten te informeren op een toegankelijke manier en is een vereenvoudigde versie van de productinformatie.
Anke Huckriede is hoogleraar vaccinologie aan de Rijksuniversiteit Groningen en legde op 25 november 2024 aan AFP uit dat er een groot verschil is tussen de bijsluiter en de productinformatie die in de video te zien is. "Deze laatste is bedoeld om de autoriteiten te informeren die goedkeuring moeten geven voordat een medicijn op de markt komt," zei ze.
In het geval van het mRNA-vaccin Comirnaty werden ook samenvattingen van de uitgevoerde klinische onderzoeken en de verkregen resultaten opgenomen in de productinformatie. Volgens Huckriede zou het feit dat "een dusdanig uitgebreid dossier wordt beoordeeld door verschillende experts en ook toegankelijk is voor iedereen juist vertrouwen moeten scheppen en toont het de transparantie van het proces aan."
Ze benadrukte ook dat een "uitgebreide productinformatie helemaal niets te maken heeft met extra bijwerkingen of meer risico's."
Informatie over 21 verschillende versies van het vaccin
Toen AFP op 22 november 2024 contact opnam met het College ter Beoordeling van Geneesmiddelen, verduidelijkte een woordvoerder dat "in het geval van vaccins die op Europees niveau worden beoordeeld en via de EMA worden geregistreerd, zoals Comirnaty, de informatie voor elke variant en elke sterkte in één document wordt gecombineerd", wat de lengte van het document verklaart.
Een woordvoerder van de EMA schreef in een e-mail op 26 november 2024 aan AFP dat "de productinformatie van Comirnaty lang is omdat het de samenvattingen van productkenmerken (SmPC), etiketteringsinformatie en bijsluiters bevat voor alle varianten, farmaceutische vormen en sterktes van het vaccin die zijn goedgekeurd sinds de eerste oorspronkelijke versie werd goedgekeurd in december 2020."
Dit is ook te zien op de Comirnaty webpagina op de EMA-site. Naast de allereerste goedgekeurde versie van het vaccin werden er nog vier verschillende versies goedgekeurd om de meest recente virusstammen het hoofd te bieden. Elk van deze aangepaste vaccins is ook beschikbaar in verschillende sterktes, afhankelijk van de bevolkingsgroep waarvoor het bedoeld is, bijvoorbeeld met een lagere dosering voor baby's en kinderen.
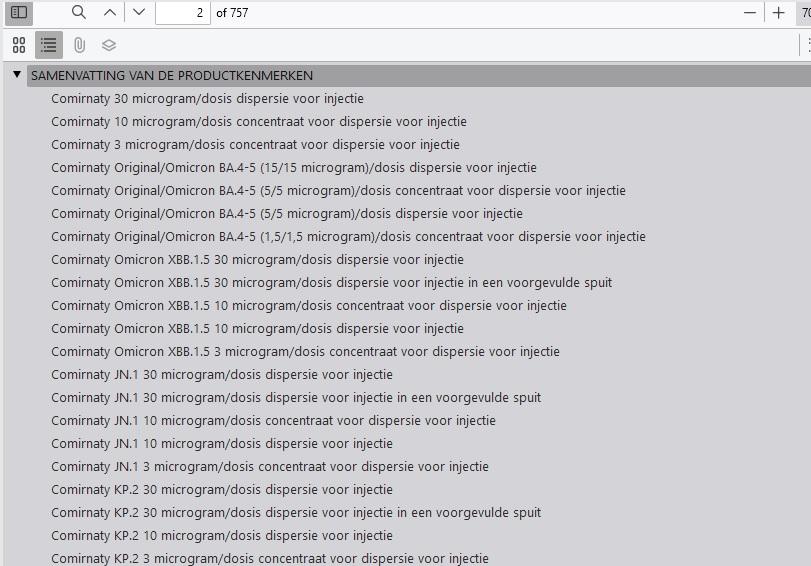
Als je naar de inhoudsopgave van de productinformatie van het vaccin kijkt, zie je dat de 757 pagina's feitelijk bestaan uit 21 afzonderlijke SmPC's of productinformatie, etiketteringsinformatie en bijsluiters. "Hoewel elk van deze documenten in overeenstemming is met wat normaal gesproken voor elk ander vaccin zou gelden, is het de som van al deze verschillende documenten die in één overkoepelend document zijn samengevoegd die de lengte ervan verklaart", aldus EMA.
De EMA-woordvoerder legde uit dat "het belangrijkste verschil tussen coronavaccins en andere vaccins voor menselijk gebruik is dat verschillende samenstellingen (strains) naast elkaar kunnen bestaan binnen dezelfde handelsvergunning. Dit geldt niet voor andere vaccins voor menselijk gebruik (bijv. influenza)."
Dit heeft te maken met de Variatieverordening van de EU. Deze staat de toevoeging van varianten toe via variatieprocedures voor dit soort vaccins.
Coronavaccins zijn veilig
Huckriede benadrukte ook dat ernstige bijwerkingen zeldzaam zijn en dat de coronavaccins veilig zijn: "Na het verstrekken van miljarden doses mRNA vaccin weten we inmiddels dat ernstige bijwerkingen gelukkig heel zeldzaam zijn, al komen ze voor." De volledige lijst met bijwerkingen is te vinden in de bijbehorende productinformatie van elk vaccin. Ze zijn vrij toegankelijk op de website van EMA in alle EU-talen (hier gearchiveerd).
De EMA-woordvoerder vertelde AFP dat "de Covid-19-vaccins die zijn goedgekeurd voor gebruik in de EU, waaronder Comirnaty, veilig en effectief zijn." "De Covid-19-pandemie heeft het grootste vaccinatieprogramma in de geschiedenis op gang gebracht en regelgevende instanties beschikken over een ongekende hoeveelheid gegevens om de veiligheid en werkzaamheid van deze vaccins te bevestigen," voegde de woordvoerder eraan toe.
AFP heeft eerder al valse beweringen over de coronavaccins en documenten in verband met het Pfizer Covid-19-vaccin gefactcheckt.
Copyright © AFP 2017-2026. Voor commercieel gebruik van deze inhoud is een abonnement vereist. Klik hier voor meer informatie.
Heeft u content gezien die u door AFP wilt laten verifiëren?
Neem contact met ons op